Oppimistehtävä 5 – esimerkit ja harjoitustehtävät
Ainemäärä
Ainemäärän tunnus on n ja sen yksikkö on mooli (mol). Yksi mooli atomeja on ![]() atomia, ja sen verran atomeja on 12 grammassa
atomia, ja sen verran atomeja on 12 grammassa ![]() -hiiltä.
-hiiltä.
Kirjoitetaan Avogadron vakio.
![]()
Moolimassa
Moolimassa on ainemäärän massa, jota on yksi mooli. Sen tunnus on M, ja sen yksikkö on g/mol.
Jaksollisesta järjestelmästä selviää suoraan alkuaineen suhteellinen moolimassa ja laskemalla yhdisteen moolimassa.
Laskuyhtälöt
Kootaan laskuyhtälöiden termit.
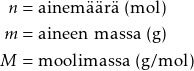
Kirjoitetaan ainemäärän yhtälö.
![]()
Kirjoitetaan aineen massan yhtälö.
![]()
Kirjoitetaan moolimassan yhtälö.
![]()
Pitoisuus
Ainemäärän ![]() avulla laskettu pitoisuus on konsentraatio, joka kertoo ainemäärän litrassa liuosta. Sen tunnus on c ja sen yksikkö on mol/l.
avulla laskettu pitoisuus on konsentraatio, joka kertoo ainemäärän litrassa liuosta. Sen tunnus on c ja sen yksikkö on mol/l.
Kirjoitetaan konsentraation yhtälö.
![]()
Tilavuus- ja massaprosentti
Tilavuusprosenttisuutta tarvitaan esim. tilanteessa, jossa kaksi toisiinsa liukenevaa nestettä on samassa astiassa. Tällaisia toisiinsa liukenevia nesteitä ovat mm. vesi ja etanoli sekä bensiini ja etanoli.
Kirjoitetaan tilavuusprosenttisuuden yhtälö.

Massaprosenttisuutta tarvitaan esim. tilanteessa, jossa kiinteää ainetta on liuennut liuotinnesteeseen. Tällaisia kiinteä aine–liuotinneste -pareja ovat mm. sokeri ja vesi sekä suola ja vesi. Massaprosenttia tarvitaan myös, kun halutaan tietää metalliseoksesta eli lejeeringistä tietyn metallin massan suhteellinen prosenttisuus.
Kirjoitetaan massaprosenttisuuden yhtälö.

Reaktioyhtälö
Reaktioyhtälö kuvaa kemiallista reaktiota.
![]()
Palaminen on esimerkiksi kemiallinen reaktio, joka vaatii happea ![]() , palavaa ainetta ja riittävän lämpötilan.
, palavaa ainetta ja riittävän lämpötilan.
Reaktionopeuteen vaikuttavat ainepari, aineiden väkevyys tai määrä, aineiden hienojakoisuus, lämpötila, aineiden sekoittaminen ja katalyytin läsnäolo.
Kemiallisessa reaktiossa eri atomien lukumäärä on aina vakio.
Kirjoitetaan hiilen palamisen reaktioyhtälö.
![]()
Kirjoitetaan vedyn palamisen reaktioyhtälö. Punaiset numerot ovat tasapainotuskertoimia.
![]()
Käyttöturvallisuustiedote
Käyttöturvallisuustiedote (KTT) on tarkka ja kattava kuvaus kemikaalin ominaisuuksista. Se on lain edellyttämä ympäristölle vaaralliselle kemikaalille ja se on kemikaalin valmistaneen yrityksen tai maahantuojan tekemä.
Käyttöturvallisuustiedote kertoo mm. onnettomuuden varalta kemikaalin ominaisuudet (LD![]() – ja HTP-arvot), mahdolliseen tulipaloon kelpaavat sammutusvälineet ja tarvittavan ensihoidon.
– ja HTP-arvot), mahdolliseen tulipaloon kelpaavat sammutusvälineet ja tarvittavan ensihoidon.
LD![]() – eli LD50– eli Lethal Dose, 50% -arvo ilmaisee aineen myrkyllisyyden. Kyseinen, määritelty letaaliannos tappaa puolet koe-eläimistä. Yleensä se ilmoitetaan tietylle antotavalle ja massaan suhteutettuna. Kaasumaisille aineille, sumuille ja aerosoleille myrkyllisyyden mittayksikkö on LC
– eli LD50– eli Lethal Dose, 50% -arvo ilmaisee aineen myrkyllisyyden. Kyseinen, määritelty letaaliannos tappaa puolet koe-eläimistä. Yleensä se ilmoitetaan tietylle antotavalle ja massaan suhteutettuna. Kaasumaisille aineille, sumuille ja aerosoleille myrkyllisyyden mittayksikkö on LC![]() eli LC50 eli Lethal Concentration, 50%. Pienempi LD
eli LC50 eli Lethal Concentration, 50%. Pienempi LD![]() – tai LC
– tai LC![]() -arvo tarkoittaa myrkyllisempää ainetta.
-arvo tarkoittaa myrkyllisempää ainetta.
Taulukossa1,2 aineen myrkyllisyyttä on arvioitu esim. rotilla.

HTP– eli haitalliseksi tunnettu pitoisuus -arvo on pienin haittaa tai vaaraa työntekijän terveydelle aiheuttava ilman kemikaalipitoisuus. Se kuvaa haitallisten molekyylien suhdetta ilmapartikkeleihin miljoonasosina (ppm eli parts per million) tai milligrammoina kuutiometrissä ilmaa (mg/m![]() ). Ilman epäpuhtauden pitoisuuden altistumisen HTP-arvo voi olla HTP8h eli kahdeksan tuntia, HTP15min eli 15 minuuttia tai hetkellinen.
). Ilman epäpuhtauden pitoisuuden altistumisen HTP-arvo voi olla HTP8h eli kahdeksan tuntia, HTP15min eli 15 minuuttia tai hetkellinen.